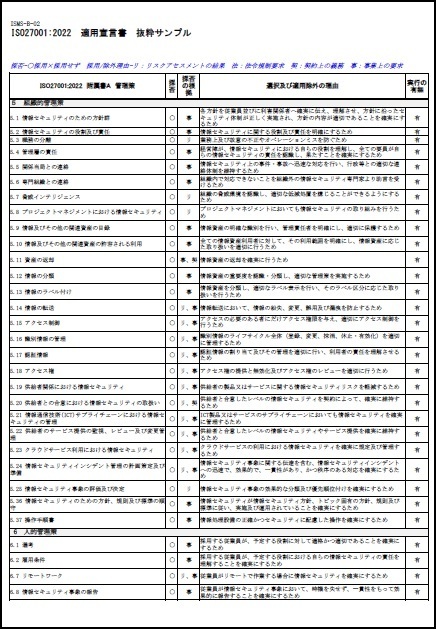
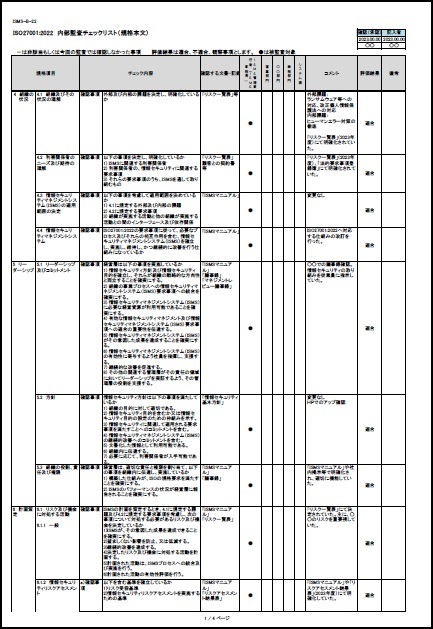
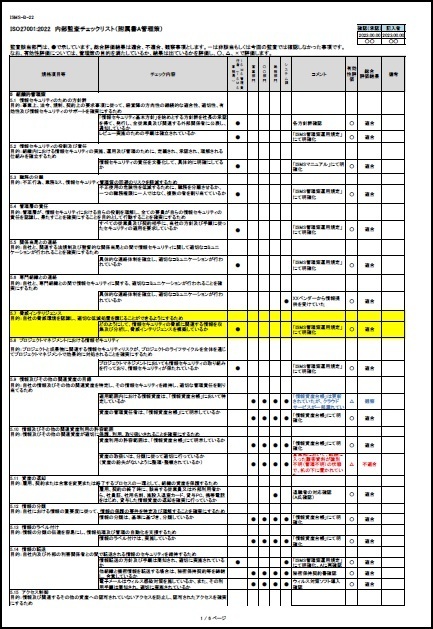
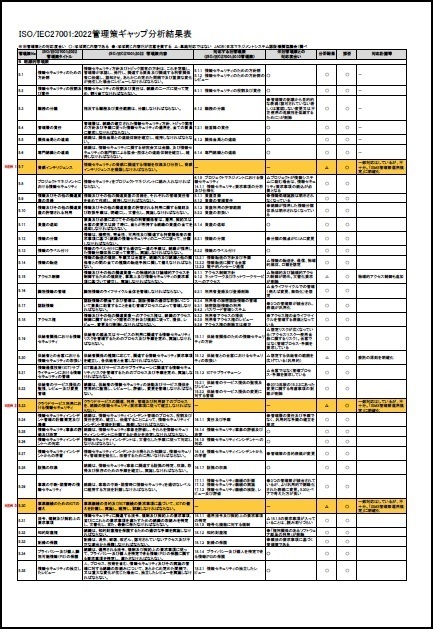
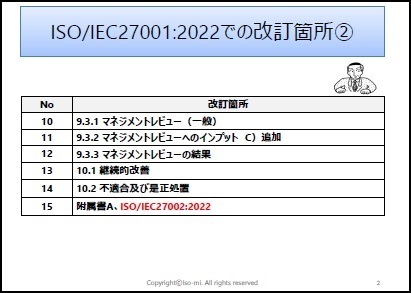
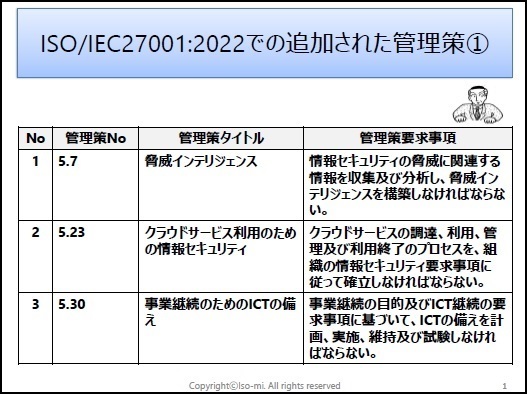
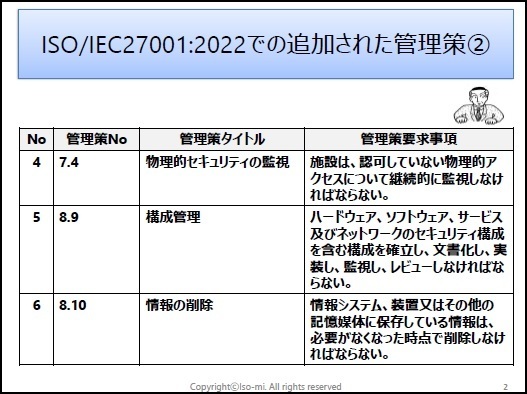
ISO/IEC27001:2022に対応したサンプル文書(雛形)を有料にて、ワードファイルで提供しています。サンプル文例は、JIS Q 27001:2025にも対応しています。
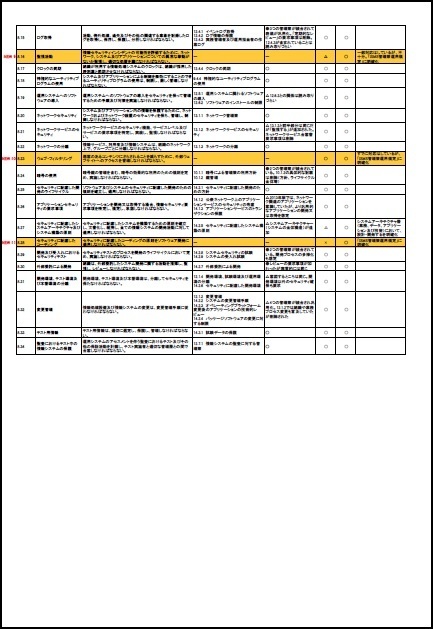
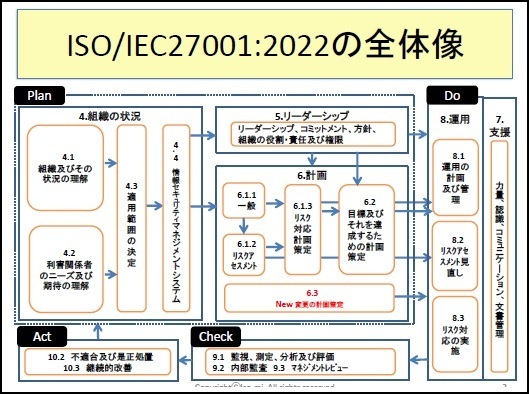
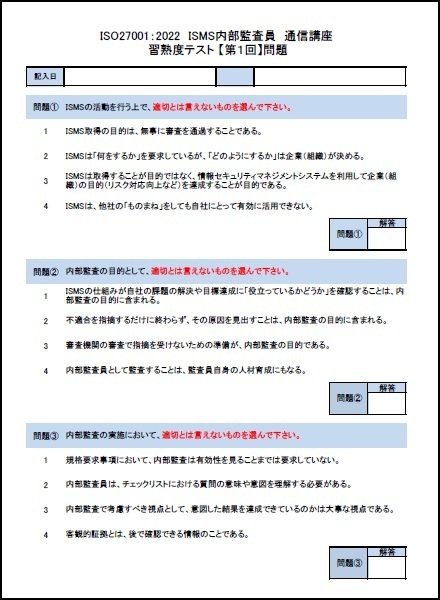
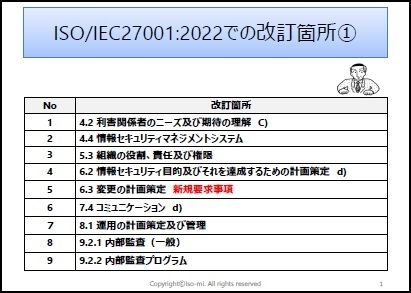
一部の見本を以下に表示します。
※上記見本には、一部の記載のみですが、実際の提供商品には、掲載目次の項目すべてが記載されています。
提供価格:16,500円(税込)
購入方法:
1.本ホームページのお問い合わせにて、購入のご連絡をお願い致します。「ISMSマニュアル2022購入希望」と明記下さい。
2.メールが届き、確認次第、ご入金口座をお知らせ致します。
3.メールに添付した御請求書に記載のある口座に、ご入金をお願い致します。※なお、振り込み手数料については、ご負担頂けますようお願い致します。
4.ご入金が確認でき次第、Eメールにて納品致します。
※また、納品したファイルが開けない、破損している場合は、その旨をご連絡下さい。交換致します。その他ご質問等は、本ホームページのお問い合わせにてお願い致します。
注意事項:
1.本商品(ISMSマニュアル2022)を転売する等の商用利用※を禁止致します。※商用利用とは、顧客等へのコンサルツールの利用も含みます。
2.本商品(ISMSマニュアル2022)にあるサンプル文例は、あくまでもサンプルですので、実際の文面は、必ず自社にあったものをお書きください。
3.個人(顧問を含む)やコンサルタント事業者様、士業様には、ご購入は、ご遠慮頂いております。